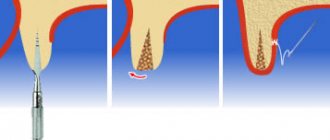
В каких случаях кость может не прижиться?
Кость может не прижиться в случаях, когда произошло ее инфицирование – в том числе, когда пациент нарушал график приема антибиотиков, не выполнял предписания доктора.
Большое внимание отводится к приему пищи: пациент элементарно может, по забывчивости, что-то надкусить твердое, и у него разойдутся швы, и через открытую рану произойдет инфицирование материала и костного графта.
Вышеназванное составляет 90 процентов случаев
, когда кость может не прижиться.
Есть ли противопоказания к костной пластике?
Безусловно, противопоказания к проведению костной пластики есть. К ним относятся
:
- различные хронические заболевания, в т.ч. сахарный диабет с высокими показателями уровня сахара,
- период, когда пациент принимает ряд препаратов, в том числе проводится химиотерапия,
- в период после проведения химиотерапии, когда кость вообще нельзя «трогать».
Особенности гигиены после проведения костной пластики
После костной пластики рекомендуется
:
- использование специальных хирургических зубных щеток,
- использование зубной пасты должно быть ограничено, а еще лучше использовать специальные пасты для послехирургических вмешательств,
Главное при проведении гигиены – НЕ ТРАВМИРОВАТЬ
область костной пластики! Нужно постараться исключить контакт с этой области или свести его к минимуму.
Вебинары по использованию EthOss от мировых клиницистов
РЕГИСТРАЦИОННОЕ УДОСТОВЕРЕНИЕ
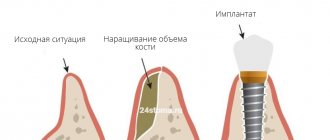
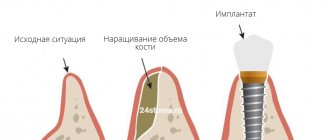
Костная пластика — одна из самых востребованных операций в челюстно-лицевой хирургии и стоматологии. Она нужна для подготовки пациента к установке дентального имплантата. Вследствие различных стоматологических патологий или длительного отсутствия зубов, кости подвергаются атрофическим процессам и становятся тонкими. Поскольку для установки и хорошей приживаемости имплантата кость должна быть достаточно плотной, костная пластика поможет исправить дефицит костной ткани.
Биологические костные материалы как правило создаются двумя способами — либо из костной ткани крупного рогатого скота, либо из трупных биоматериалов, тоесть из кости умерших людей. Да, это разрешено в большинстве стран, но согласитесь, в 21 веке использовать такую методику уже кажется не совсем современным способом восстановить улыбку, к тому же существует большой риск получить аллергическую реакцию, или личную непереносимость пациентом данных материалов, а также возникновение перекрестного заражения кости.
Поэтому технологии давно не стоят на месте, и британские клиницисты нашли выход из данной ситуации, и создали полностью безопасный синтетический костный материал, вызывающий естественную регенерацию кости человека, состоящий из бета-трифосфата кальция и сульфата кальция. Называется данная разработка — костный материал EthOss (Этос)
EthOss — это костный материал, разработанный имплантологами для имплантологов. Он состоит из абсолютно биосовместимых материалов, которые стимулируют процессы регенерации кости. Не содержит животных или человеческих компонентов.
Использование данного материала позволило достигнуть клинического успеха у огромного количества специалистов, так как EthOss устраняет необходимость в донорских трансплантатах и искусственных каркасах. Встроенный барьер устраняет необходимость в дополнительных мембранах и ускоряет хирургический процесс. Результатом этого становится более быстрая операция с минимально низким порогом боли для пациента.
Как проходит имплантация при костной пластике?
Имплантация при костной пластике может проводиться либо одномоментно с костной пластикой, либо отсрочено – когда имплантаты устанавливаются уже в новую «выросшую» кость.
Я, как опытный хирург-имплантолог, в своей практике в 80-90 процентов случаев делаю костную пластику одновременно
с имплантацией.
Объясню почему пластику с имплантацией выполняю одномоментно, и в чем преимущество такого подхода. Костная пластика, сама по себе, требует большого срока приживления, от 4-х до 9-ти месяцев. И если мы выдерживаем этот срок, а потом делаем имплантацию, то потом нам надо выжидать еще 4 месяца. То есть сроки в этом случае значительно увеличиваются.
А в случае, если я делаю имплантацию вместе с костной пластикой, то имплантат приживается вместе с костью. У хорошего имплантата отличная остеогенерирующая поверхность, и при сращивании получается отличный результат
.
Тем самым сокращаются сроки реабилитации пациента. И самое важное – пациенту НЕ ТРЕБУЕТСЯ
второе хирургическое вмешательство. Мы же понимаем, что большое количество хирургических вмешательств не улучшает ни трофику, ни слизистую, ни костную ткань.
Все, что мы делаем в Немецком имплантологическом центре, от удаления зуба до имплантации, проводится максимально атравматично для пациента.
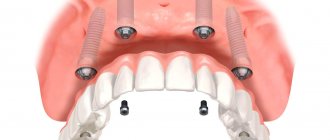
Какое количество имплантатов ставится при тотальном восстановлении?
Мы очень широко специализируемся на тотальной реабилитации на имплантах. На верхней челюсти рекомендовано 6-8 имплантатов по нашему протоколу, на нижней челюсти достаточно 6 имплантатов для тотальной реабилитации.
Зачастую происходит имплантация одновременно с установкой временных зубов, то есть пациент уходит из клиники «с зубами», причем не на второй-третий день, а в тот же день, когда делается имплантация:
Предварительно по КЛКТ проводится планирование имплантации, имплантаты расставляются в нужных позициях.
После этого изготавливается хирургический шаблон, по которому происходит установка имплантов. И на основе этой же компьютерной томографии (КЛКТ) и снимков изготавливается временная конструкция, которая будет крепиться на установленных пациенту имплантах.
И получается т.н. «полный кейс» — это когда пациент приходит, при необходимости, если того требуют обстоятельства, удаляют зубы (или они уже были удалены/потеряны ранее), пациенту ставятся импланты и фиксируется ортопедическая конструкция – его новые зубы.
Кто придумал костный материал EthOss?
Данный состав костного материала придумали два клинициста — доктор Питер Фейрберн и доктор Пол Харрисон.
Доктор Питер Фейрберн, профессор Школы стоматологии Детройтского университета (Мичиган, США), директор по образованию Ассоциации стоматологической имплантологии (Великобритания), один из президентов Лондонской стоматологической ассоциации, и доктор Пол Харрисон( член организаций PHD, MBA, BSC). Также он является мировым специалистом по дизайну стоматологических изделий.
После карьеры в академической сфере в Университете Лидса, др. Пол Харрисон основал независимую консалтинговую фирму по изобретению передовых материалов. Один успешный проект включал разработку метода растяжения кости с использованием внешних фиксаторов для укрепления сращения после перелома. Благодаря этому Пол увлекся вопросом костной регенерации.
С самого начала EthOss разрабатывался с учетом потребностей стоматологов. Настоящая костная регенерация это нечто большее чем использование костных материалов для создания обьема и искусственного каркаса. Доказано, что использование EthOss способствует более быстрому росту нативной кости при незначительных болевых ощущениях. С 2015 года его популярность среди стоматологов и пациентов растет очень быстро, чему так же способствовала британская Онлайн-Академия. Материал EthOss придуман и разработан клиницистами в Великобритании и доступен по всему миру.
На какой челюсти быстрее происходит рассасывание кости зубов?
Как быстро возникает дефицит кости, костной ткани при отсутствии зуба.
На самом деле быстрее костная ткань зуба убывает на верхней челюсти, поскольку верхняя челюсть более мягкая и более пористая. На нижней челюсти кость уходит также достаточно быстро, поскольку вестибулярная пластинка у зубов довольно тонкая. По истечение шести месяцев после потери зуба происходит достаточно сильная атрофия костной ткани, причем атрофия прогрессирует. И поэтому, чтобы избежать атрофии, желательно делать имплантацию одномоментно сразу при удалении зуба.
Такой формат – регулярная, ежедневная работа специалистов Немецкого имплантологического центра. Например, пациент приходит с трещиной в корне зуба – зуб надо удалять. Мы можем пойти двумя вариантами:
Вариант 1.
Можем удалить зуб и спустя 3 месяца провести имплантацию зуба пациенту. Но за эти три месяца все равно происходит усадка костной ткани, так как — я говорил ранее – вестибулярная костная пластина очень тонкая. И в этом случае пациенту проводится
2 хирургических вмешательства
: первое – это удаление зуба, второе хирургическое вмешательство – установка зубного импланта.
Вариант 2.
В своей практике мы рекомендуем и практикуем именно второй вариант. Это одномоментная имплантация, когда пациенту удаляется зуб, устанавливается имплант и для того, чтобы не было коллапса костной ткани в тех местах, где раньше были корни зуба, данные места заполняются костным графтом. За счет наполнения графтом у нас не происходит «схлопывания» тканей, сохраняется контур и десны, и костной ткани челюсти. Чего, в свою очередь, очень сложно добиться при отсроченной, отложенной имплантации.
Кому можно делать костную пластику?
Кто является потенциальными пациентами на костную пластику, и какие существуют для нее возрастные ограничения.
Это немного коварный вопрос :). Самый взрослый пациент, которому я делал костную пластику – это пациент 75-летнего возраста, замечательная целеустремленная женщина. У нее на нижней челюсти были двухсторонние концевые дефекты. Она очень хотела имплантацию, отказывалась от съемной конструкции.
Этой женщине я провел костную пластику одномоментно с имплантацией. И буквально через 6 месяцев она была запротезирована. И все прошло отлично.
В случае возраста пациента главное, чтобы у него не было противопоказаний. Возможно, возрастные ограничения и существуют, но они не столь выражены, поскольку , хотя с возрастом и ухудшается трофика, регенерирующие способности уменьшаются, но главное – наличие противопоказаний. Нужно смотреть анализы, и если пациент в свои 75 лет здоров, то — почему бы и нет?
Материалы для аллоимплантации
На сегодня существует достаточное количество различных видов материалов, которые хорошо себя зарекомендовали в ортопедической и имплантационной стоматологии. Ниже представлен небольшой список продуктов для аллоимплантации:
- Продукт американской компании AlloSource под названием ADLB, представляет деминерализованную лиофилизированную кортикальную аллокость, обладает остеоиндуктивным эффектом. Время заполнения костного дефекта составляет 6-12 месяцев.
- Продукт американской компании CeraMed под названием Allograft, представляет деминерализованную аллокость в виде мелких частиц, обладает остеоиндуктивным эффектом. Время заполнения костного дефекта составляет 6-12 месяцев.
- Продукт американской компании AlloSource под названием AlloGro, представляет деминерализованную аллокость в виде костной крошки с доказанной остеоиндуктивностью. Используется для заполнения костных дефектов, костная мозоль образуется на 10 -14 день с момента имплантации.
- Продукт американской компании Synthes под названием DBX, — деминерализованный костный матрикс, обладающий остеоиндуктивным и остеокондуктивным эффектом на протяжении 6 месяцев.
- Продукт американской компании GenSci Regeneration Sciences под названеим DynaGraft, — деминерализованный костный матрикс с возможностью остеоиндуктивного эффекта. Используется для заполнения костных дефектов с достижением желаемого эффекта в течение 6-12 месяцев.
- Продукт американской компании Osteotech под названием Grafton DMB, — деминерализованный костный матрикс с остеоиндуктивным эффектом и достижением желаемого эффекта в течение полугода.
- Продукт американской компании Pacific Coast Tissue Bank под названием Ламбон, — деминерализованный лиофилизированный аллогенный имплантат, изготовленный в виде пластины. Обладает остеоиндуктивным эффектом, разграничительная функция действует в течение 4-5 месяцев, а полного эффекта имплантации достигает через 6-8 месяцев.
- Продукт российской компании Костный банк ЦИТО им. Приорова под названием Перфрост. Представляет собой деминерализованную лиофилизированную кортикальную аллокость и обладает остеоиндуктивным эффектом. Время заполнения костных дефектов составляет от 15 до 90 дней.
Наращивание костной ткани нижней челюсти
Операция также имеет свою специфику, так как в этой проекции располагается большое скопление нервов, нижнечелюстного канала, височно-нижнечелюстного сустава и т.п. Важно подсадить кость аккуратно, не задеть и не передавить окончания нервов.
Для нижней челюсти характерна подсадка донорского состава, который берется из области зубов мудрости или же подбородочной части. Донорский блок фиксируется с помощью металлических винтов, просветы заполняются костной стружкой. Через несколько месяцев, как только блок прижился, винты извлекаются, можно переходить к процедуре имплантации.
Самый распространенный вопрос: можно ли обойтись без восполнения объема кости? Да, в некоторых случаях можно. Например, при экспресс-имплантации, когда корневидный имплантат внедряется сразу же после удаления своего зуба. Практически во всех других случаях, даже если с момента удаления зуба прошел месяц, без наращивания костной ткани не обойтись. Но эта операция является гарантией стабильного положения имплантата – надежности, долговечности и идеального результата имплантации и протезирования.
Виды, источники происхождения и состав
В общих чертах, все существующие барьерные мембраны можно разделить на две группы: резорбируемые и нерезорбируемые. Также существуют мембраны с очень длительным периодом резорбции и их, вроде как, пытаются выделить в отдельный класс, но на мой взгляд, их следует отнести к резорбируемым, ибо в конце концов они всё равно рассасываются и исчезают. Нерезорбируемые мембраны изготавливаются из разных биоинертных материалов (тефлон, ПТФЭ, титановые сплавы и т. д.), используются они значительно реже, про них мы поговорим, когда будем рассматривать остеопластику методом НКР.
Здесь и далее, мы будем говорить о наиболее распространенных в хирургической практике резорбируемых барьерных мембранах.
Основной компонент существующих на рынке барьерных мембран – это коллаген, органическое вещество белковой природы, главный структурный элемент соединительной ткани. Источником коллагена для барьерных мембран на 98% являются лучшие друзья и, заодно, еда человека – свинки. Изредка используется аллоколлаген (человеческого происхождения) или что-то другое (биополимеры, производные полисахаридов и т. д.).
Главная причина использования коллагена для производства барьерных мембран – это его предсказуемый распад естественным путём с помощью ферментов-коллагеназ и образованием, обычных для организма аминокислот. Без лишних продуктов распада и прочих ЛСД.
Ну, да ладно. Нас, конечных потребителей барьерных мембран, волнуют не столько секреты производства, сколько ряд критериев, важных для практики. Они, в целом, похожи на то, что мы ждём от остеографтов и биоматериалов вообще, и включают в себя:
Форм фактор.
размеры, упаковка, и т. д. Одна и та же барьерная мембрана может быть разной площади. Так, используемая нами Geistlich Bio-Gide выпускается в размерах 16х22, 25х25 и 30х40 мм
И мы выбираем нужный размер, в зависимости от масштабности хирургического вмешательства.
Физические и биологические свойства.
По аналогии с остеографтами, барьерные мембраны должны обладать рядом физических и биологических свойств.Конечно информация о свойствах важна, в первую очередь, для доктора, а не для пациента. Однако, представление о свойствах необходимо и вам, друзья, для понимания того, как мы, врачи, ориентируемся, выбирая барьерную мембрану для решения той или иной клинической задачи.
гидрофильность – ну, это само собой, ведь жидкость – это главная транспортная среда организма.
прочность – способность барьерной мембраны сохранять целостность при нагрузке и фиксации. Она не должна превращаться в лохмотья, если мы решили её забить пинами или прикрутить винтами, подлежащий графт не должен прорезываться, а натянутая мембрана – расползаться.
эластичность – барьерная мембрана должна принять форму того участка, к которому мы её адаптируем. Без лишних заломов и обработки напильником.
адгезия – идеальная барьерная мембрана, буквально, прилипает к подлежащему графту и, чаще всего, не требует какой-то специальной фиксации.
Про свойства барьерных мембран можно очень долго рассуждать. И мы однажды это сделаем, в ходе эксперимента под названием “М.П.”. Вам же, друзья, нужно про свойства два момента:
– физические свойства определяют то, как ведёт себя барьерная мембрана в ходе операции. Облегчает ли она работу доктора и удешевляет ли её, или наоборот, усложняет и требует применения чего-то дополнительного. Пинов и винтов, к примеру.
– биологические свойства определяют то, что происходит с барьерной мембраной после операции. Они трудноизмеримы и, практически, неизучимы объективно. Поэтому, апеллируя к биологическим свойствам, можно “впарить” вам всё, что угодно. Именно поэтому такие критерии как “проницаемость” и “время резорбции”, до сих пор являются предметов ожесточённых споров, дискуссий, драк и прочих зарубов в профессиональном стоматологическом сообществе. И, именно поэтому я призываю вас как можно меньше им верить.
А нам с вами осталось рассмотреть еще одну категорию биоматериалов:
Вместо пролога. Что такое биоматериалы?
С точки зрения толкового словаря, под биоматериалами подразумеваются любые чужеродные вещества и объекты, внедряемые в организм и дополняемые его структурно или/и функционально, и использующиеся в медицинских целях. То есть, биоматериалами можно назвать искусственные клапаны сердца, эндопротезы, имплантаты, в т. ч. дентальные, металлоконструкции, применяемые при остеосинтезе, гемостатические средства, зубные протезы, коронки, вкладки, пломбы и т. д. И наоборот, сережки для пирсинга, краски для татуировок, всякие страшные штуки для боди-моддинга к биоматериалам, в правильном их понимании, не относятся.
То, что мы используем для “наращивания костной ткани”, было бы правильнее назвать “биоматериалами для регенеративной хирургии”, что конкретизирует и объясняет их назначение. В общих чертах, современный стоматологический рынок предлагает нам три категории таких материалов – остеографты, барьерные мембраны и мукографты:
Чуть позже, мы подробно рассмотрим каждую из этих категорий.
Говорить о показаниях и противопоказаниях к использованию биоматериалов с точки зрения пациента достаточно сложно, поэтому их использование в ходе тех или иных остеопластических операций – вопрос, относящийся больше к конкретной методике, нежели к самому материалу. Поэтому мы будем рассматривать его в статьях, посвященных определенным методикам остеопластики. То есть, скоро.
Но, в целом, уважаемые друзья, вам нужно знать следующее:
– использование биоматериалов – это всегда компромисс, вынужденная мера.
Да, теоретически и практически, мы могли бы обходиться без них. И тому есть масса примеров:
уточню, что на двух правых снимках – временная коронка на установленном имплантате. Биоматериалы для остеопластики в данном клиническом случае не применялись.
Но в таких случаях мы сталкиваемся с проблемой – если нам необходимо возместить атрофическую утрату кости или слизистой оболочки, то её необходимо где-то взять. И нередко процесс получения аутотрансплантата (т. е., собственного фрагмента тканей для пересадки) увеличивает травматичность, сложность и продолжительность хирургического вмешательства. А иногда вообще является отдельной хирургической операцией со всеми вытекающими: повышаются риски осложнений и снижается безопасность хирургического лечения. Совершенно логичным выглядит желание всего этого избежать, заменив аутотрансплантат чем-то “искусственным”.
– ни один из существующих биоматериалов не улучшает качество регенерирующих тканей.
Это микроскопная фотография того, что получается после остеопластики с использованием биоматериалов.
Если мы говорим, к примеру, о “наращивании костной ткани”, то ни один из остеографтов, используемых в современной хирургической практике, не делает кость крепче, прочнее, красивее и т. д. Более того, то, что мы получаем в результате использования “искусственных заменителей кости”, сложно назвать костью в биологическом смысле – скорее, это костная мозоль с включением частиц биоматериала(как на микроскопной картинке выше), её свойства и структура сильно отличаются от нормальной здоровой костной ткани. Если уж говорить совсем серьезно, то использование графтов “ухудшает” качество тканей. Но мы вынуждены идти на этот компромисс, чтобы восполнить их объем и, соответственно, создать условия для нормальной имплантологической реабилитации.
– не существует биоматериалов, ускоряющих регенерацию тканей.
Я бы даже сказал больше – от марки, производителя или страны происхождения биоматериала мало, что зависит. Все существующие в мире графты и барьерные мембраны работают одинаково, по одним и тем же биологическим законам. Категорически неправильно утверждать, что “этот материал работает лучше, чем этот” или “вот этот хороший, а этот – полное говно!”. Безусловно, биоматериалы отличаются между собой целым рядом свойств, и сегодня мы с вами обязательно поговорим об этих свойствах.
– у каждой из категорий биоматериалов есть своё назначение и чётко прописанная функция.
Прямо как на этой картинке:
Использовать биоматериалы не по назначению – это, как минимум, серьезно рисковать результатом. Например, мы можем попытаться с использовать гемостатическую губку для заполнения субантрального пространства при синуслифтинге. И, возможно, мы даже получим хороший результат. Но, только слово “возможно” меня лично очень смущает. В хирургии использование этого слова должно быть сведено к минимуму.
– использование биоматериалов должно быть обоснованным и понятным, прежде всего, вам.
“Сюда засунем, здесь приколотим” … иными словами, использование графтов и барьерных мембран, – это всегда отличный способ завысить стоимость лечения или искусственно усложнить предстоящую операцию. И действительно, установленные имплантаты можно пересчитать, по контрольным снимкам легко определяется их марка и модель, а вот определить объем де-факто использованного при синуслифтинге графта или размер установленной барьерной мембраны (да и вообще, наличие этой самой мембраны) не так уж и просто. Если вы по каким-то причинам не понимаете, для чего необходимо использование биоматериалов в вашем клиническом случае, значит, они не нужны. Об их применении в различных клинических ситуациях мы поговорим в последующих статьях, когда будем изучать каждый из существующих методов остеопластики. Ну и, после операции имеет смысл “свериться” с реальным расходом биоматериалов – все графты и барьерные мембраны используемые в современной хирургии, имеют специальные наклейки с указанием их параметров и серийных номеров, – одна наклейка остаётся в медицинской карте, вторая вклеивается в договор, на контрольный снимок или специальный бланк, которые передаются пациенту.
Наконец, последнее, от того не менее важное:
все существующие биоматериалы – одноразовые. Одна упаковка предназначена ТОЛЬКО для одной операции:
Это, собственно, значит, что во-первых, неиспользованные остатки биоматериалов нельзя повторно стерилизовать и использовать, а во-вторых, что отсутствие вышеуказанной наклейки говорит о том, что в вашем лечении, возможно, был использован “левый” материал или остатки с какой-то другой операции. Категорически не рекомендую на этом экономить, ибо правильно простерилизовать уже открытый материал в условиях обычной стоматологической клиники без потери его свойств невозможно.
В принципе, уважаемые друзья, знания вышеперечисленного вполне достаточно, чтобы понять, нужны ли недешевые, в общем-то, биоматериалы для наращивания костной ткани конкретно в вашем клиническом случае. На всякий случай напоминаю, что
если вы чего-то не понимаете, – значит вам это не нужно.
Вспомните, хотя бы, вот эту статью>>.
В рамках семинаров RegenerationDay by Geistlich, мне удаётся не только повысить чувство собственной важности, но и побеседовать с докторами из различных клиник, городов и регионов нашей страны. И я не могу не замечать зловредную тенденцию – чрезмерное злоупотребление биоматериалами, бестолковое желание затолкать их туда, где они, в принципе, не нужны. Многие в них видят какую-то панацею, некую “волшебную таблетку”, способную, если не гарантировать, то улучшить результат любой остеопластической операции. Увы, это не так.
В нашем стоматологическом центре делается очень много остеопластических операций – больше двухсот с начала года. При этом, расход биоматериалов относительно небольшой – они используются меньше, чем в половине случаев. Почему? Для ответа на этот вопрос нужно, как минимум, прочитать вот это>> или просто заглянуть к нам в клинику на консультацию.))
Мнение специалиста
Игорь Юрьевич Малиновский
Челюстно-лицевой хирург, имплантолог
Стаж: более 11 лет
Остеопластическая операция нередко предшествует имплантации зубов. Особенно в тех, случаях, когда зуб был удален более года назад. Без нагрузки кость проседает, атрофируется, ее объема становится недостаточно для установки импланта. Именно поэтому так важно заниматься восстановление зубов сразу после их удаления. При большом количестве отсутствующих зубов единственным способом обойтись без остеопластики может быть базальная имплантация с более глубокой установкой имплантов в твердые слои костной ткани.
Как обойтись без подсадки кости
Можно ли обойтись без костной пластики и синус-лифтинга?
Да, в некоторых случаях можно обойтись без подсадки кости. Но нужно понимать – если у пациента нет костной ткани, и мы установим имплантат, то коронка будет нависать над десной, и туда будет постоянно что-то забиваться из пищи. То есть и эстетически это некрасиво, и туда будет вся пища забиваться, пациент будет всегда иметь «кармашек пищевых запасов» из вчерашней и позавчерашней еды.
Вариант с имплантом меньшего диаметра
Можно поставить имплант меньшего диаметра, и при этом мы можем провести мягкотканную регенерацию – подсадить слизистую (это может быть соединительная ткань с нёба, с бугра верхней челюсти). И тем самым мы добиваемся восполнения объема мягких тканей. За счет этого визуально улучшается эстетика и устраняется проблема с гигиеной.
Всегда, когда можно избежать различных хирургических манипуляций, но не в ущерб качеству, то надо их избегать.
То есть операция ради операции – она не нужна
.
Аутогенные остеопластические материалы в стоматологии
По данным литературы, чаще всего в хирургической стоматологии используется аутопластический метод — пересадка кости, полученной из другой части тела самого пациента. Впервые аутогенный трансплантат испытан хирургом Уолтером в 1820.
На протяжении последующих двух веков материал, полученный от пациента, традиционно считался «золотым стандартом
» остеопластики. Не в последнюю очередь это было обусловлено несовершенством технологий обработки чужеродных остеопластических материалов и низким развитием химического производства, ограничивающим доступ к более совершенным опциям.
Сторонники аутогенных графтов указывают на высокую остеогенность (за счет наличия клеток), остеокондукцию (благодаря содержанию минералов и коллагена) и остеоиндуктивные свойства (за счет неколлагеновых белков костного матрикса).
По своей структуре аутотрансплантаты могут быть кортикальными, губчатыми и губчато-кортикальными. Принято считать, что при использовании губчатых костных материалов происходит более быстрая и полноценная реваскуляризация трансплантата.
Это возможно благодаря содержанию плюрипотентных клеток
, которые способны дифференцироваться и пролиферировать, участвуя в остеогенезе. В кортикальных графтах указанные процессы протекают медленно.
Ряд исследователей считают, что губчато-кортикальные фрагменты за счет прочной кортикальной части обладают достаточными механическими свойствами, а губчатая составляющая способствует повышению остеогенного потенциала.
Чаще всего внеротовыми участками для забора остеопластического материала служит нижняя челюсть, реже — тазовая кость, латеральный край лопатки или ребро. По мнению зарубежных специалистов, ткань из тазовой кости и челюсти отличается высоким регенеративным потенциалом и меньше поддается резобрции.
В любом случае, только для получения аутогенного остеопластического материала необходимо выполнять дополнительное вмешательство. Это означает привлечение анестезиологов и хирургов, дополнительные риски и затраты.
Если для выполнения остеопластики требуется получить внутриротовой трансплантат, оптимальным донорским участком является тело либо ветвь нижней челюсти, ретромолярная область, подбородочный симфиз и горб верхней челюсти.
Забор биоматериала производится под местной анестезией, что упрощает весь лечебный процесс, однако дополнительная травматизация и риски остаются.
Стоит упомянуть, что одной из основных причин отказа от данного вида остеопластики является страх пациентов перед хирургическим вмешательством и естественное желание закончить лечение с минимальной кровью (в буквальном смысле).
Несмотря на очевидные преимущества аутотрансплантатов (биосовместимость, инфекционную безопасность, регенеративный потенциал), они имеют существенный недостаток. Проблема заключается в резорбции трансплантата в динамике, преимущественно при использовании внеротовых графтов
.
Нужно помнить о возрастных аспектах, переносимости дополнительного хирургического вмешательства у отдельных категорий пациентов.
Метод с осторожностью используется в пожилом и детском возрасте, в том числе из-за недостаточного количества кости и риска повреждения ростовых зон у детей.
Необходимость забора кости всегда сопряжена с дополнительным риском инфицирования донорского участка, кровопотерей, увеличением продолжительности послеоперационного периода, повышенной потребностью в обезболивающих препаратах, ростом медицинских расходов и др.
Потребность в преодолении этих недостатков аутотрансплантации обусловили быстрое развитие альтернативного метода — аллотрансплантации. Впервые в мире новаторский метод замещения костных дефектов, при котором донором выступает другой человек, использовали в 1880 году под руководством Уильяма Макьюэна.
Преимущества деминерализованной лиофилизированной кости с доказанной остеоиндуктивной активностью
Среди всех представленных на рынке материалов можно выделить продукт под названием АллоГро от крупнейшего банка тканей в США. Этот препарат является деминерализованным имплантатом лиофилизированной кости, остеоиндуктивная активность которого определяется посредством проб. Необходимость проведения этой пробы заключается в том, что индуктивные свойства донорской ткани сильно выражены, а проведение биопробы отсеивает около 10% доноров для производства материала для имплантации. Сегодня с целью экономии средств для теста на остеоиндуктивную активность в лабораториях используют культуры клеток типа SAOS-2 (остеогенная человеческая саркома), в которую помещают тимидин и КМП донора. В результате определяется активность клеточного деления и скорость выведения тимидина. Эти данные позволяют рассчитать остеоиндуктивную эффективность.
В результате этих клинических исследований, компания смогла присвоить продукту ярлык «Доказанная остеогенная активность». Одним из рисков при применении аллогенных трансплантатов является передача вирусной инфекции, такой как гепатит или СПИД. Но на сегодняшний момент не запечатлены случаи инфицирования каким-либо вирусом, даже теми инфекциями, зоной для развития которых является твердая мозговая оболочка. Сегодня ДЛК является самым экономичным и эффективным остеогенным материалом.